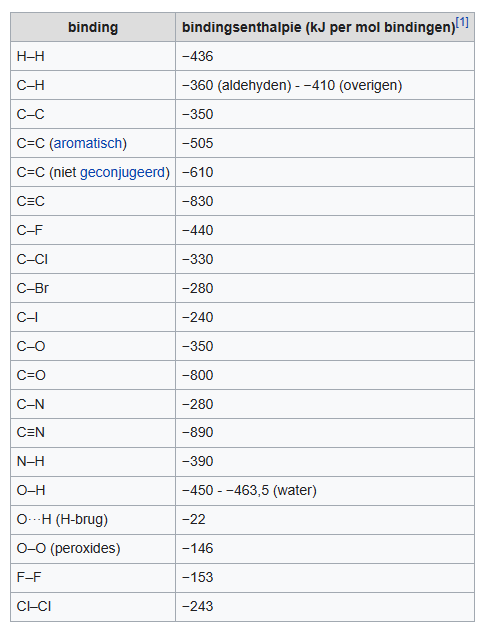
De bindingsenthalpie is de enthalpieverandering (energie) die bij het vormen van een atoombinding (zowel een enkelvoudige, dubbele of drievoudige binding) tussen twee atomen vrijkomt bij binding of nodig is bij verbreking ervan . De enthalpieverandering is de hoeveelheid warmte (energie) die vrijkomt of wordt opgenomen bij een proces waarbij begin- en eindtoestand dezelfde temperatuur en druk hebben. Bij het vormen van een atoombinding komt warmte vrij en daardoor is de bindingsenthalpie negatief. Bij het tegengestelde proces, het verbreken van een atoombinding, is de enthalpieverandering positief.
In de volgende tabel zijn gemiddelde waarden van bindingsenthalpie opgenomen. (bron: wikipedia.nl)